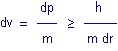La mécanique quantique c’est quoi?

Introduction à la mécanique quantique
La mécanique quantique c’est quoi?
Introduction
La Mécanique est la science qui étudie le mouvement des corps
La Mécanique classique (dite de Newton) étudie les corps de « grandes » dimensions
dont Vitesses négligeable par rapport à la lumière (300 000 km/s)
La Mécanique relativiste (dite de Einstein) se divise en relativité restreinte et relativité générale et concerne les corps de « grandes » dimensions dont les vitesses ne sont pas négligeable par rapport à la lumière.
La Mécanique quantique concerne les corps de dimensions moléculaires ou atomiques
Pour expliquer les problèmes posés par la mécanique quantique, il est utile de voir
comment la physique classique décrit le monde. et quels changements la mécanique quantique introduit par rapport à cette description.
et quels changements la mécanique quantique introduit par rapport à cette description.
En mécanique classique on considère des particules qui se déplacent selon des trajectoires.
Elles ont donc à tout moment une position, et la façon dont cette position change
détermine leur vitesse (et la façon dont leur vitesse change détermine leur accélération et
ainsi de suite).
Ces trajectoires sont entièrement déterminées par deux facteurs : d’une
part les forces qui agissent entre les corps, d’autre part les « conditions initiales » du
système considéré, c’est-à-dire l’état dans lequel se trouve le système au temps initial.
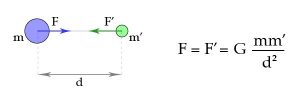
La notion de ‘force’ est relativement intuitive lorsqu’on pense aux forces de contact ; par
exemple si l’on pousse sur un objet ou qu’on le tord.
Mais la physique classique ne peut pas se limiter à ce genre de force : elle introduit également des forces gravitationnelles, par exemple, qui agissent «à distance » (c’est-à-dire sans contact direct entre les corps), même à travers le vide, et, en principe, de façon instantanée. Le caractère peu intuitif de cette force a amené Newton à dire qu’il « ne forgeait pas d’hypothèses » concernant sa nature.
Simplement, on peut la formuler de façon mathématiquement précise, l’introduire dans des équations et en déduire des conséquences, par exemple sur les mouvements des planètes ou des satellites, ou des mouvements sur terre, et ces conséquences sont en accord de façon tout à fait remarquable avec l’expérience et l’observation.
Quelles sont les idées généralement admises aujourd’hui par le grand public
au sujet de l’atome ?
A la fin du XIXème siècle, les lois de la nature semblaient totalement connues à travers la théorie de la gravitation (Newton) et de l’électromagnétisme (Maxwell).
Deux types de mouvements mutuellement exclusifs étaient connus :
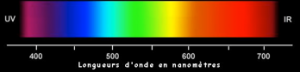
–Mouvement ondulatoire :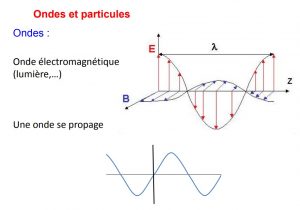
Caractérisé par la fréquence et la longueur d’onde λ d’un signal oscillant.
La lumière est considérée comme une onde à cause des phénomènes d’interférences (Young).
–Mouvement d’un solide :
Caractérisé par sa masse, sa position et sa quantité de mouvement

Il restait « juste » quelques petits points obscurs ….
La lumière (rayons X, ultraviolet, visible, infrarouge) se propage à travers l’espace sous forme d’une onde électromagnétique; car on observe des phénomènes propres aux ondes, comme la réflexion, la réfraction, l’effet Doppler, les interférences.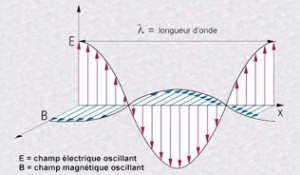
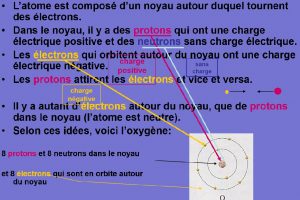
L’électron et le proton sont connus.
La réalité de l’atome est admise, mais sa structure n’est pas connue précisément.
Le neutron n’est pas connu, il ne sera découvert qu’en 1932 par James Chadwick (1891-1974), prix Nobel en 1935.
Premier problème : la catastrophe ultra violette.
Lorsque l’on chauffe un solide parfait (appelé corps noir), il émet des ondes électromagnétiques dans un domaine de longueurs d’ondes caractéristique de sa température.
A l’époque, l’énigme est appelée la catastrophe ultraviolette !
Qu’est-ce qu’un corps noir ?
C’est un corps qui absorbe toute l’énergie qu’il reçoit (c’est à dire qu’il n’y a aucune réflexion)
L’énergie qu’il émet sous forme de rayonnement dépend de sa température.
Exemple: Le soleil
Les théories classiques en vigueur ne parviennent pas à expliquer les observations faites sur l’émission de l’énergie par un corps noir.
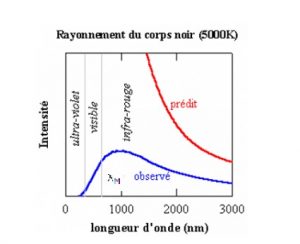
Expérimentalement la courbe présente un maximum lié à la température par la relation de Wien :
λM *T = 2,9.10-3 m.K
- En 1900, Rayleigh ne parvient pas à expliquer théoriquement ce phénomène. Son calcul amène à une équation qui diverge dans l’ultra violet (C’est ce qui a été appelé catastrophe).
octobre 1900, Max Planck
En 1900, Max Planck a pu prédire comment le spectre d'émission d'un objet changerait avec la température
Il a pu faire ces prédictions après avoir suggéré que l''on pouvait avoir une petite quantité de rayonnement (lumière).
Planck a proposé qu'il y ait une restriction fondamentale sur les niveaux d'énergie qu'un objet émet ou absorbe et il a appelé
ces petites quantités d'énergie un quantum (une quantité fixe)
La théorie de Planck crée une relation entre la fréquence/longueur d'onde et l'énergie de l'objet
Octobre 1900: en s’appuyant sur les travaux de Wien (loi de Wien),prix Nobel en 1911, Max Planck trouve une équation qui rend compte des observations et résout l’énigme de l’émission radiative d’un corps noir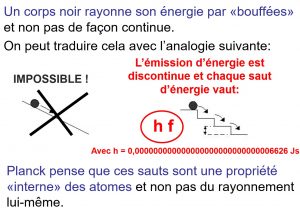
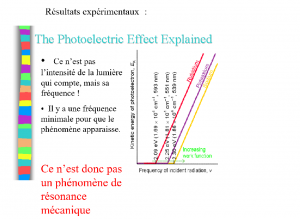
Second problème : l’effet Photoélectrique.
Des électrons sont éjectés de certains métaux lorsque ceux ci sont éclairés !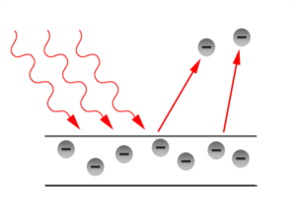
Interprétation classique : résonance entre l’oscillation de l’onde de lumière et une oscillation (hypothétique) des électrons. Mais alors si on augmente l’intensité de l’onde les électrons devraient être éjectés plus facilement.
Troisième problème : Le spectre atomique
Les atomes absorbent et émettent de la lumière d’une manière discontinue. Seuls certaines longueurs d’ondes sont absorbées ou émises.
Le modèle planétaire classique ne permet pas d’expliquer cela.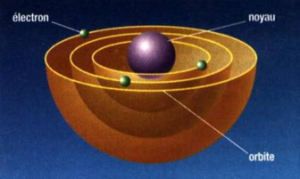 Très mauvais modèle
Très mauvais modèle
 Celui là aussi!
Celui là aussi!
Le photon : une particule de lumière
Max Planck introduit l’idée de photon dans son étude théorique du corps noir.
Chaque photon transporte une énergie proportionnelle à la fréquence de l’onde qui lui est associée.
Ephoton= hν
Il introduit la constante de proportionnalité « h » : constante de Planck
h=6,62 10-34 J s
Il parvient alors à trouver la forme théorique de la courbe du corps noir et la loi de Wien s’exprime par :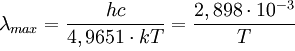
Où k (constante de Boltzmann) et c (vitesse de la lumière) sont des constantes déjà établies.
Richard Feynman, célèbre physicien (1918-1988) connu notamment pour ses diagrammes de désintégrations de particules disait ; «Si vous croyez comprendre la mécanique quantique c’est que vous ne la comprenez pas».
Lorsque l’on sait que Planck lui-même, alors qu’il établissait la loi de Planck, démontrant que l’énergie se propageait par paquets de valeur « h*f » h, une constante appelée: constante de Planck et f : la fréquence de l’onde de propagation, doutait de cette réalité !

Lorsque l’on sait qu’Einstein à propos de la physique quantique et de ses manifestations probabilistes s’exclamait «Dieu ne Joue pas aux dés» !

Même Schrödinger, le père de la mécanique quantique et découvreur de l’équation fondamentale de la mécanique quantique était très sceptique vis-à-vis de celle-ci. !
Alors on peut admettre qu’il y ait quelques difficultés à comprendre la mécanique quantique.
Le comportement très spécial des particules qui semblent pouvoir emprunter plusieurs chemins dans le même temps trouble le sens commun et n’aide pas à clarifier les esprits rationnels.
Au comble de l’incohérence, quasiment au sens propre, une particule pourrait être dans des états «superposés» ou «probabilistes» – 50% intacte – 50% désintégrée.
Descartes y mangerait son chapeau !
Il faut tout de même souligner que la mécanique quantique, plus encore
que la mécanique classique, a donné lieu à un nombre spectaculaire de prédictions
surprenantes, allant des particules élémentaires aux étoiles, en passant par la chimie
et la physique de l’état solide, prédictions tout aussi spectaculairement confirmées par
l’expérience et l’observation. Elle est à la base de toute l’électronique moderne, c’est-à-dire
de l’informatique et des télécommunications.
Histoire abrégée
Le terme « mécanique » qui englobe la science du mouvement et ses propriétés n’est plus du tout approprié à « la quantique » qui englobe aujourd’hui tous les domaines de la physique et dont les ramifications s’étendent jusqu’en astrophysique, en cosmologie, en optique numérique, en biochimie, jusqu’à inclure l’Homme. Malgré cette évolution, le substantif « mécanique » a gardé voix de citer et est assimilé à celui de « physique » quantique. Aussi, par tradition certains auteurs le conserve comme titre de chapitre ou l’utilisent indifféremment ci et là selon leur humeur.
Les prémices

Devant les prodigieuses avancées des sciences et des techniques au cours du XIXeme siècle, le chimiste français Marcellin Berthelot s’était exclamé : “il n’y a pas un problème que la science ne puisse résoudre”
Pour juger objectivement les phénomènes qui obéissent aux lois de la physique quantique, un résumé de son histoire soulignera le cheminement intellectuel qui entraîna son introduction dans la physique classique et qui finira par la remplacer dans le domaine de l’atome.
Arrivé à ce point, complété par les notions de Relativité, la distinction entre la physique de Newton, celle d’Einstein ou de Heisenberg ne fera plus de doute.

Lord Kelvin (William Thomson) Sir William Thomson, Lord Kelvin (1824-1907) Physicien, mathématicien et ingénieur anglais, originaire de Belfast en Ulster, Lord Kelvin élabore une échelle théorique des températures en 1848 : l’unité de température absolue qui porte son nom, le kelvin.
Lord Kelvin avait ressenti la même impression et considéra vers 1852 que : “la physique avait fourni une description cohérente et a priori complète de l’univers”.
Malheureusement ces certitudes étaient basées sur une vision bien naïve du monde, un monde considéré comme stable et éternel.
La Science ne se souciait guère des aspects négatifs des découvertes, elle ne posait pas de questions sur son origine, ses retombées, son éthique.
Que devenait dans ce monde simple et sans mystère, les paradoxes, la conscience, la dimension transcendante du monde, le non-sens ?
Comment avons-nous appris que la théorie classique ne s’appliquait pas à toute la réalité ?
Les théories concernant les différents états de la matière, la chaleur spécifique ou la réaction des métaux photosensibles ne suivaient pas les courbes standards.
Si les savants avaient bien trouvé des formules pour prédire ces événements, certains corps s’écartaient obstinément des valeurs moyennes pour des raisons qui restèrent longtemps mystérieuses.
 C’est la thermodynamique qui donna le coup d’envol de la résolution de ces problèmes. Mais elle-même enchâssée dans le carcan de la philosophie séculaire et contrainte par la physique classique eut de grosses difficultés pour évaluer la portée de la nouvelle mécanique quantique.
C’est la thermodynamique qui donna le coup d’envol de la résolution de ces problèmes. Mais elle-même enchâssée dans le carcan de la philosophie séculaire et contrainte par la physique classique eut de grosses difficultés pour évaluer la portée de la nouvelle mécanique quantique.
La thermodynamique est la branche de la physique qui traite de la dépendance des propriétés physiques des corps à la température, des phénomènes où interviennent des échanges thermiques, et des transformations de l’énergie entre différentes formes.
La thermodynamique peut être abordée selon deux approches différentes et complémentaires : phénoménologique et statistique.
La thermodynamique phénoménologique ou classique a été l’objet de nombreuses avancées dès le xviie siècle. Elle s’appuie sur des considérations macroscopiques pour établir un nombre réduit de principes et de lois, issus d’observations expérimentales.

La thermodynamique statistique, qui s’est développée à partir du milieu du xixe siècle, s’appuie quant à elle sur des considérations moléculaires et sur le calcul des probabilités appliqué à un grand nombre de particules.
Elle s’attache à analyser la structure de la matière et à établir un lien entre ses propriétés et les principes de la thermodynamique phénoménologique.
Principe zéro de la thermodynamique: Si deux systèmes sont tous deux en équilibre thermique avec un troisième, ils sont en équilibre thermique l’un avec l’autre.
La première loi de la thermodynamique et c’est le principe de la conservation de l’énergie , ce qui signifie que l’ énergie ne peut être ni créée ni détruite , mais plutôt transformée en différentes formes au fur et à mesure que le fluide contenu dans le volume de contrôle est étudié.
C’est la loi la plus importante pour l’analyse de la plupart des systèmes et celle qui quantifie la transformation de l’ énergie thermique en d’autres formes d’énergie . Il s’ensuit que les machines à mouvement perpétuel du premier type sont impossibles.
L’étude des gaz parfaits et celle des machines thermiques, qui échangent de l’énergie avec l’extérieur sous forme de travail et de chaleur, occupent une place centrale dans la thermodynamique : elles ont permis le développement de très nombreuses machines et méthodes industrielles, et servi de base à d’importantes découvertes en chimie, en astrophysique et dans de nombreux autres domaines scientifiques.
Jusqu’au XXeme siècle, la matière n’intéressait pas les physiciens. Cette science était réservée aux chimistes parmi lesquels nous retrouvons les célèbres Avogadro, Gay-Lussac, Boyle et tant d’autres. L‘Encyclopedia Britannica publiée en 1771 considérait que les atomes étaient les plus petits corps naturels indivisibles, des minima minimorum naturae. Or depuis Démocrite on avait déjà remarqué que certains atomes ou plutôt certaines molécules étaient structurées et présentaient des formes variées et qu’aucunes d’elles ne pouvaient se transformer en une autre. L’or et le plomb pouvaient bien s’amalgamer mais il était toujours possible de les séparer par l’action de la chaleur. Cette définition était donc incomplète et suscita l’intérêt des chercheurs.

Vers 1774, Antoine Laurent de Lavoisier découvre que les corps composés tels que l’air ou les minéraux sont constitués d’éléments simples, mélangés dans des proportions bien déterminées. Lavoisier découvrit 23 éléments chimiques simples. Il est à juste titre considéré comme l’un des créateurs de la chimie moderne. Il faudra attendre une génération pour que John Dalton propose le concept atomique en 1803 : il considère que la matière est constituée de molécules qui sont elles-mêmes composées d’atomes indivisibles.

Vers 1860, August Kekulé von Stradonitz et Butlerow démontrent grâce à la lumière polarisée que les molécules des gaz obéissent à un comportement structurel particulier, ce qui leur permettra d’échafauder les principes de l’architecture chimique. C’est également Kekulé qui précisa le sens des termes d’atomes et de molécules dans leur définition moderne.

Neuf ans plus tard Dimitri Mendéléev proposa une classification des éléments selon leur masse atomique mais il ne put expliquer les relations entre classes d’éléments.

Il faudra attendre quelques générations pour découvrir les propriétés électriques des atomes et leur architecture.
La fin du XIXeme siècle fut marquée par la découverte des rayons X (Roentgen, 1895)
Un an plus tard c’est la radioactivité naturelle qui est découverte (Becquerel, 1896).


En 1903, les physiciens anglais Ernest Rutherford et Frederick Soddy découvrirent que la radioactivité naturelle était une transmutation d’un atome dans un autre. Ainsi, les atomes radioactifs pouvaient émettre des particules positives (rayonnement a, un noyau d’hélium), négatives (rayonnement b, des électrons) ou des ondes de très courtes longueurs d’ondes (rayons g). Mais il restait à localiser les composantes du rayonnement a et en corollaire celles du noyau.

Quatre ans plus tard, J.J.Thomson proposa un modèle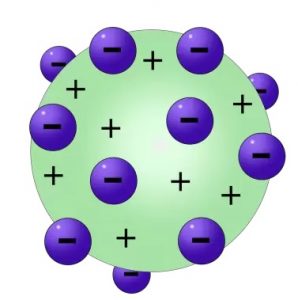 atomique dans lequel les charges négatives – les électrons – étaient distribués dans une matrice chargée positivement.
atomique dans lequel les charges négatives – les électrons – étaient distribués dans une matrice chargée positivement.
Pour respecter la neutralité de la matière, les électrons devaient avoir exactement les mêmes valeurs que les charges positives.
Entre-temps les chimistes et les physiciens ont essayé d’évaluer la dimension des molécules et de déterminer la nature des forces qui les maintenaient ensembles. Mis à part les auteurs précités, les travaux les plus concrets et qui témoignèrent d’une ébauche de solution furent ceux de R.Brown sur le mouvement brownien datant de 1828.
Comme le rappelle son nom, le mouvement brownien a été découvert en 1827 par le botaniste Robert Brown (1773-1858). C’est en observant sous un microscope du pollen dispersé dans de l’eau qu’il remarqua que les grains microscopiques le constituant étaient soumis à un mouvement continuel et irrégulier.
Il crut, à l’époque, qu’il avait découvert « la molécule primitive » responsable de la vie. Il s’aperçut plus tard que l’on pouvait observer ce même phénomène avec toutes sortes de particules de taille suffisamment petite.
Plus tard R.Clausius en 1857 qui fit la distinction entre les différents états solides, liquides et gazeux en fonction de l’agitation moléculaire.
Ces travaux seront souvent discutés et critiqués en termes d’entropie et de leur cohérence vis-à-vis des lois classiques. Il était évident aux yeux de Planck, Boltzmann ou Sommerfeld que les phénomènes naturels et en particulier la loi d’entropie ne pouvait être réduite à des phénomènes purement mécaniques.

Ces recherches se termineront avec la célèbre thèse de doctorat d’Einstein en 1906.
Einstein a passé une thèse de doctorat en 1905 décernée par l’université de Zurich. Celle-ci est étroitement liée à ses travaux sur le mouvement brownien et l’existence des atomes.
C’est l’année où il publie également ses articles fondateurs sur les quanta de lumière et la relativité. Il est autorisé à donner des cours à l’université de Berne dès 1908, tout en continuant de travailler au Bureau des brevets.
De 1908 à 1909, grâce aux travaux d’Einstein qu’il utilise, Jean Perrin va mener ses expériences sur l’existence des atomes qui lui vaudront le prix Nobel de physique.
On savait alors que le rayon de l’atome d’hydrogène oscillait entre 1 et 2×10-8 cm et l’on estima le nombre d’Avogadro N à environ 6.02 x 1023 molécules par mole.
Peu de temps après la publication de cette formule, Einstein établit une correspondance entre le mouvement brownien isolé et la diffusion d’un ensemble de particules.
Einstein voulait ignorer les détails des phénomènes de collisions et traita la diffusion comme un processus de Markov.
Un exemple simple de processus de Markov:
Un groupe d’étudiants arrivés la même année, à travers les trois
niveaux d’une licence. Ces trois niveaux sont des états, ils seront notés L1,
L2 et L3. Après le troisième niveau, les étudiants réussissant leurs examens obtiennent le diplôme de licence : ils ont atteint l’état D. Enfin, chaque année, les étudiants peuvent décider de quitter la licence. Ils se retrouvent alors dans l’état Q. Les étudiants peuvent également redoubler une fois, ou davantage, chaque niveau. Chaque année, les étudiants ont une probabilité p de passer dans le niveau supérieur, une probabilité q de quitter la licence et une probabilité r de redoubler.
Pour simplifier la description, nous considérerons que les étudiants qui quittent la licence ne peuvent pas y revenir, que les probabilités
p, q et r sont les mêmes chaque année et que le nombre de redoublements
n’est pas limité.
La chaîne de Markov correspondante estLes 5 états et les 6 probabilités de transition pour la chaîne
de Markov modélisant un parcours de licence simplifié.
Sa théorie sera appliquée avec succès dans tous les domaines exploitant les propriétés d’élasticité, de viscosité et d’écoulement de la matière, en bref la rhéologie.
Son travail touchera l’industrie du bâtiment (le ciment), la météorologie (les aérosols) ainsi que les secteurs touchant à la minéralogie et la chimie alimentaire.
A côté de la détermination de la dimension des molécules, les physiciens étaient également préoccupés de savoir comment le mouvement se transmettait dans la matière. Les physiciens savaient depuis longtemps, en fait depuis qu’ils avaient observé un morceau de bois flotté à la surface de l’eau, qu’une onde ne consistait pas en un déplacement de la matière mais bien à un mouvement dans celle-ci.
On démontre ce principe quotidiennement par de nombreux mobiles, dont celui des billes suspendues en contact les unes avec les autres présenté à droite.
 En lançant la première bille sur la deuxième, quasi instantanément le choc se propage à travers les autres billes provoquant le déplacement de la dernière. Toutes les billes situées entre les deux extrémités restent immobiles. La propagation se transmet de bille à bille, en d’autres termes une certaine quantité d’énergie se propage dans la matière à une vitesse finie.
En lançant la première bille sur la deuxième, quasi instantanément le choc se propage à travers les autres billes provoquant le déplacement de la dernière. Toutes les billes situées entre les deux extrémités restent immobiles. La propagation se transmet de bille à bille, en d’autres termes une certaine quantité d’énergie se propage dans la matière à une vitesse finie.
Le même phénomène explique la propagation du son dans l’air. Ainsi, qu’elles soient électromagnétiques ou élastiques, les ondes obéissent à une relation de propagation, la fonction de l’onde, qui n’est pas équivalente à une fonction d’onde.

Au XIXeme siècle grâce aux travaux de Maxwell, les physiciens connaissaient son équation généralisée aux dérivées partielles, sur laquelle nous nous attarderons en temps utile à propos de la théorie du champ.
Mais à l’époque, il ne venait encore à l’idée de personne d’imaginer que l’atome puisse être représenté par une fonction d’onde.
L’œuvre majeure de Maxwell est la création de la théorie de l’électromagnétisme. Reprenant la conception des lignes de force, électrique ou magnétique, due à Michael Faraday, il introduit la notion de champ et crée en 1862 le concept de « courant de déplacement », apparaissant dans les diélectriques soumis à un champ électrique variable. Puis il montre que, de même que la variation d’un champ magnétique provoque l’apparition d’un champ électrique (phénomène d’induction découvert par Faraday), on doit admettre, symétriquement, qu’un champ magnétique est créé par la variation d’un champ électrique. Maxwell est ainsi amené à formuler les célèbres équations aux dérivées partielles qui portent son nom, condensant toutes les lois connues de l’électromagnétisme.
La mécanique ondulatoire

Face à la théorie de Heisenberg, un nouveau concept était en train de naître.
En 1924, le physicien français Louis de Broglie imagina que les atomes pouvaient se comporter comme les ondes ce qui lui vaudra le prix Nobel.
Les fréquences « quantiques » qui s’accordaient parfaitement avec la formule de Nicholson-Bohr et la constante de Planck, n’obéissaient plus tout à fait à la théorie classique de Bohr.
Il fallait donc modifier la théorie et étant donné que personne n’avait jamais observé un électron sur son orbitale, Louis de Broglie se demanda pourquoi ne pas en arriver à une modification radicale du concept atomique… Il était un fait que ce que nous savions de certains atomes était uniquement lié aux raies spectrales et à leur intensité…
Ayant parfaitement maîtrisé les travaux d’Einstein, Louis de Broglie considéra que la lumière, avec ses propriétés ondulatoires était constituée de photons (et leur attribua avec erreur une masse). Sachant qu’il existait une relation entre l’énergie des particules et la fréquence de leurs rayonnements, de Broglie inventa la “mécanique ondulatoire”, faisant l’hypothèse qu’à toute particule de masse m et de vitesse v était associée une onde de longueur d’onde λ et de fréquence ν :
![]()
![]()
De Broglie généralise la relation des quanta ν = E/h à toutes les énergies et toutes les particules, plus seulement aux photons sans masse.
A partir de cette fréquence (concept ondulatoire), il peut calculer les caractéristiques de l’onde de phase de ce phénomène périodique.
L’équation de Schrödinger
Qui est Erwin Schrödinger ?
Erwin Schrödinger est né le 12 août 1887 à Vienne, en Allemagne. Schrödinger était une personne très douée avec un large éventail d'intérêts dans différents domaines d'études. Schrödinger était connu pour aimer les disciplines scientifiques, la logique de la grammaire ancienne et la poésie allemande. (La source: Prix Nobel)
Schrödinger est devenu un maître des problèmes de valeurs propres dans la physique des médias continus en 1906 jusqu'à ce qu'il serve comme officier d'artillerie pendant la Première Guerre mondiale. Après son service, il a occupé plusieurs postes dans le domaine académique.
Il fut l'assistant de grands esprits comme Hasenöhrl de 1906 à 1910, Franz Exner en même temps qu'il assistait Hasenöhrl et Max Wien en 1920.
Schrödinger a occupé des postes de professeur dans différentes universités de premier plan, Stuttgart, Breslau et Zurich, pendant six ans. Il a également occupé quelques autres postes dans diverses universités à Berlin, Oxford, Princeton, Graz. Peu après, Schrödinger a déménagé à l'Institut d'études avancées nouvellement créé à Dublin, puis est devenu directeur de l'École de physique théorique. Il est resté à Dublin jusqu'à sa retraite en 1955.
La vie de Schrödinger a été consacrée à différents domaines de la science, publiant de nombreux articles, articles et même le livre "Qu'est-ce que la vie". Schrödinger a également été crédité de la création de la base de la mécanique des ondes quantiques en 1926, maintenant connue sous le nom d'équation d'onde de Schrödinger.
Schrödinger est décédé le 4 janvier 1961 dans sa ville natale de Vienne, en Allemagne, à l'âge de 74 ans.
L’équation de Schrödinger a été établie sous sa forme primitive en 1926 par Erwin Schrödinger et a été généralisée par Paul Dirac quelques années après. Initialement, elle reprenait les idées des mathématiciens Hamilton et Félix Klein pour prolonger la théorie des ondes de matière de De Broglie.
Le théorème démontré par Schrödinger en 1926 décrit les caractéristiques d’une particule, ou plus exactement l’équation de propagation commune à toutes les ondes, appelée un « paquet d’ondes ». Si Schrödinger confirma l’hypothèse de Broglie et lui donna son assise mathématique, il n’expliquait pas ce que représentait une fonction d’onde, ce que pouvait être une onde d’électrons, d’atomes ou de molécules. Les physiciens utilisaient ces concepts mais s’interrogeaient sur leur réalité.
On peut facilement se représenter un rayon de lumière qui se propage en ondulant.
On peut aussi se représenter une onde sonore qui n’est qu’une onde de compression de l’air.
Mais comment diable pouvait-on représenter un “paquet d’ondes” ?
Que restait-il de ce “paquet d’ondes” lorsqu’il entre en collision avec un atome ?
Se brise-il vraiment en mille morceaux ainsi que le stipule l’équation de Schrödinger ?
Mais dans ce cas, l’électron doit aussi se briser, et ce n’était pas ce qui se produit dans la réalité…
Prise de becNiels Henrik David Bohr est un physicien danois.
Il est surtout connu pour son apport à l’édification de la mécanique quantique, pour lequel il a reçu de nombreux honneurs. Il est notamment lauréat du prix Nobel de physique de 1922
En septembre 1926, Bohr invita Schrödinger à Copenhague mais tous deux restèrent inflexibles sur l’interprétation de la nouvelle théorie.
Aux yeux de Bohr, la théorie ondulatoire, de caractère continu était incompatible avec le phénomène discontinu que représentaient les « sauts quantiques ».
Pour Schrödinger, l’interprétation probabiliste était irréaliste.
Dans son esprit, l’atome devait être conçu comme un tout, une « vibration universelle » car sa fonction d’onde contenait toutes les informations de la particule.
En fait Bohr et Schrödinger n’interprétaient pas les résultats expérimentaux de la même façon. Il faudra attendre une année pour réconcilier les deux physiciens.

La fonction d’onde complexe
Pratiquement, l’équation de Schrödinger permet de calculer la forme de l’onde Y qui est associée à une particule de masse m, située au point q de coordonnées (x,y,z) au temps t. Ainsi que l’exprime la formule de Schrödinger, la fonction d’onde Y est complexe, elle incorpore un facteur « i » qui ne permet pas de se l’imaginer dans l’espace classique, ordinaire.
Comme toute variable imaginaire, « i » se représente dans un plan perpendiculaire à l’axe du temps ou de l’axe des abscisses, dans une nouvelle dimension spatiale.
Pour une fonction d’onde complexe, il faut recourir à un plan de projection complexe qui vient se superposer aux dimensions spatiales réelles x,y,z, de façon à pouvoir décrire la fonction Y dans l’espace.
Le carré de l’amplitude de probabilité, |Y|2 peut ainsi être projeté sur ces nouveaux axes réels et complexes.
Ces explications en termes probabilistes déplurent à une majorité de physiciens qui appartenaient tous à l’école déterminisme.
Ce manque de précision ne les satisfaisait pas mais il fallait s’y accoutumer, d’autant que quelques mois plus tard, Heisenberg allait encore abattre un pan de l’édifice érigé à la gloire du déterminisme.
 En 1926, Heisenberg fit un exposé sur la mécanique quantique à l’Université de Berlin qui éveilla l’intérêt d’Einstein.
En 1926, Heisenberg fit un exposé sur la mécanique quantique à l’Université de Berlin qui éveilla l’intérêt d’Einstein.
Après le colloque, celui-ci lui avait fait remarquer que « fonder une théorie physique sur des grandeurs observables peut sans doute aboutir à des résultats mais cette sorte de philosophie n’en reste pas moins absurde.[…]
C’est seulement la théorie qui décide de ce qui peut être observé« .
Ce commentaire surpris Heisenberg.
Ce n’est que quelques mois plus tard qu’il comprit la portée de cette remarque : c’était la clef de l’énigme quantique !
En effet, toute la question était de savoir si on observait bien la réalité au cours des expériences ou si la théorie n’imposait pas certaines limites à notre perception du réel ?
A la fin de l’année, Pauli écrivit à Heisenberg pour lui dire qu’il avait trouvé un « point noir » dans le comportement des atomes : on ne pouvait pas attribuer une orbitale déterminée à une particule et simultanément connaître sa quantité de mouvement (son impulsion p) et sa position (q). Si l’une était mesurable, l’autre devait être « moyennée sur l’ensemble des valeurs« !
Cet étrange comportement des « q-nombres » permit à Heisenberg de trouver la solution qu’il espérait. Il comprit que la diffusion de la longueur d’onde d’une particule dans une région de l’espace plutôt qu’en un point précis signifiait que toute détermination corrélée de sa position et de sa quantité de mouvement seraient entourées d’incertitudes.
Puisque la théorie ne peut rien expliquer se dit-il, la réponse doit être indéterminée.
Nous étions en 1927, Heisenberg venait de formuler ses « relations d’incertitudes », qu’on appelle également à tord le « principe d’indétermination » car il n’a rien d’un principe malgré ce que semble signifier sa traduction anglaise.
Les relations d’incertitudes de Heisenberg
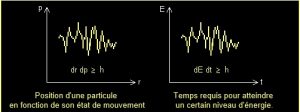
Heisenberg illustra son point de vue : en relevant la trajectoire d’un électron explique-t-il, je peux anticiper sa position et sa vitesse future.
Mais ses dimensions sont tellement petites que je dois l’éclairer avec une « lumière » de très courte longueur d’onde également, par exemple des rayons gamma.
Heisenberg démontra ainsi que plus on essayait de préciser la position d’une particule plus son mouvement devenait incertain.
L’énergie du rayonnement frappait l’électron et du même coup modifiait sa trajectoire. L’observateur « perturbait » en fait le système en cherchant à préciser les mesures de position et de vitesse.
L’énergie absorbée par l’électron modifiait sa vitesse tandis que son mouvement dépendait maintenant d’un facteur extérieur.
Heisenberg dit qu’il est en fait impossible de déterminer simultanément la position et le mouvent car les particules ne possèdent pas ces deux caractéristiques en même temps, comme cela n’a pas de sens de dire qu’une particule suit une trajectoire.
Heisenberg appliqua le théorème de Fourier au théorème de Schrödinger : toute variation d’énergie d’une particule correspond au passage d’une fonction d’onde (1). Heisenberg formalisa cette hypothèse en tirant deux inéquations déterminées par le quantum d’action, h :
Les expériences sur l'interaction matière - rayonnement révèle que l'échange discontinu d'énergie par quanta est réglé
par la constante universelle de Planck h dont l'unité est celle d'une action.
h=6,6253.10−34 J.s
La constante de Planck h mesure une quantité d'action, c'est-à-dire une énergie fois un temps.
On peut montrer que la dimension de l'action est aussi celle d'une distance fois une quantité de mouvement.
Les interprétations de l'effet photoélectrique et du rayonnement électromagnétique du corps noir montrent que par h est échangée,
dans les interactions entre matière et rayonnement, une certaine quantité d'action.
La constante de Planck h est aussi appelé quantum d'action et c'est sous la forme du quantum d'action h qu'apparaît le discontinu
dans la physique des systèmes microscopiques.
dE dt ≥ h (1)
dr dp ≥ h (2)
L’inéquation (1) signifie que même l’énergie et le temps obéissent aux principes de la physique quantique.
Le fait de connaître l’énergie d’une particule empêche de connaître la durée du phénomène.
Concrètement, plus l’énergie d’une particule est élevée, plus courte sera sa durée de vie.
L’inéquation (2) lui permet d’écrire sur base de la mécanique quantique la relation suivante :